
Acelerando o design molecular com IA: BioNemo na fronteira da biotecnologia
Introdução
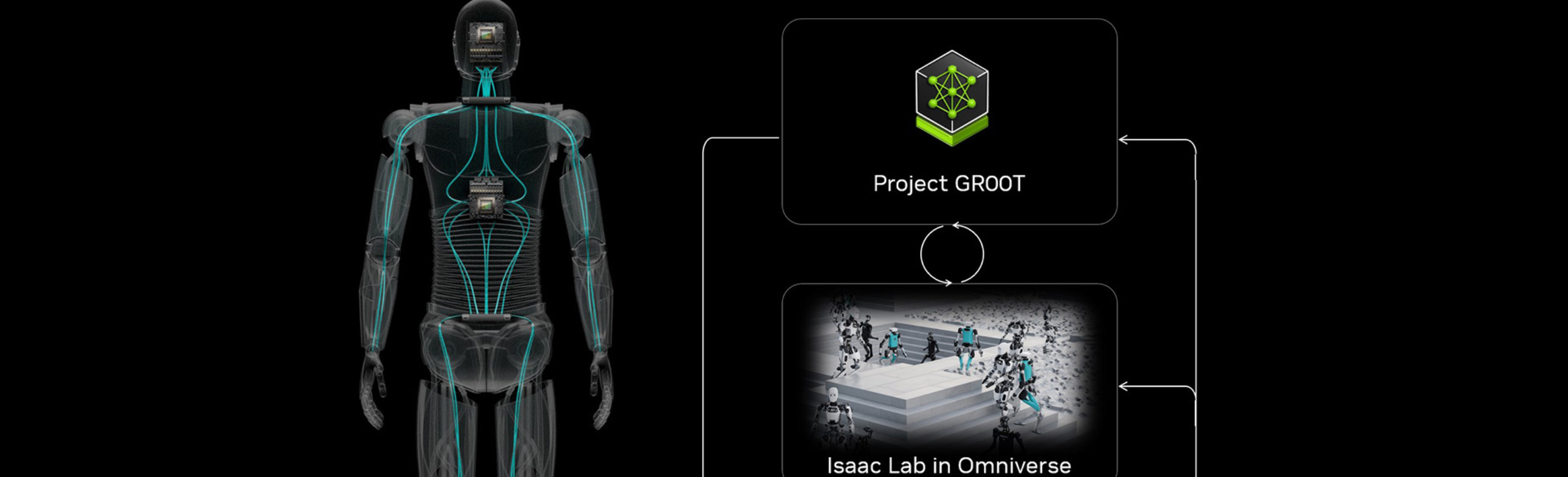
Na era da biologia baseada em IA, a NVIDIA Bionemo A plataforma surgiu como uma ferramenta fundamental para equipes modernas de P&D em biotecnologia e farmácia. Não é apenas uma estrutura para IA modelos, é um ecossistema completo para descoberta molecular
De modelos de linguagem a moléculas
BioneMo estende os da NVIDIA NeMO estrutura em ciências da vida, suportando uma variedade de modelos generativos de IA para proteínas, DNA, RNA e moléculas pequenas. De proteínas de dobramento usando Separado, para gerar compostos semelhantes a medicamentos via Mega Molbart, o BioNemo está profundamente enraizado nas arquiteturas de transformadores e otimizado para aceleração de GPU.
Além dos modelos em si, é como esses modelos são embalados e entregues. Com BioNemo NIM microsserviços, os modelos são implantados como APIs. Isso significa que os pesquisadores podem executar previsões com uma simples chamada REST, incorporando a IA diretamente nos fluxos de trabalho de produção. O BioNemo preenche a lacuna entre a IA avançada e as tarefas moleculares do mundo real, desde Diff Dock encaixe alimentado para Porta T5 design de proteína impulsionado.
O BioNemo inclui um conjunto de modelos básicos especializados em diferentes tarefas moleculares, desde a previsão da estrutura até o design generativo:
- Separado: Predição rápida da estrutura de proteínas em 3D diretamente da sequência de aminoácidos.
- Mega Molbart: Modelo generativo para moléculas pequenas no formato SMILES, treinado com um rico contexto químico.
- Diff Dock: Predição de acoplamento ligante-proteína usando modelagem generativa baseada em difusão.
- Porta T5: Modelo de linguagem proteica para incorporar sequências e gerar novas variantes.
Para aqueles que desejam explorar ou integrar os modelos do BioNemo em fluxos de trabalho personalizados, a NVIDIA fornece acesso de código aberto à estrutura completa e aos componentes subjacentes:
- Repositório NeMO no GitHub: A estrutura principal para treinar e servir grandes modelos de linguagem
- Repositório BioneMo no GitHub: Uma extensão específica de domínio do NeMO adaptada para ciências biológicas, oferecendo ferramentas, pontos de verificação pré-treinados e exemplos para biologia generativa.
Esses repositórios permitem que as equipes experimentem, ajustem e implementem modelos em ambientes flexíveis, de notebooks a clusters de escala corporativa.
Fluxos de trabalho e diagramas completos
Uma das ofertas mais valiosas do BioNemo é seu conjunto de domínio específico plantas. Esses são fluxos de trabalho completos e multimodelos que refletem casos reais de uso de P&D. Quer criar um aglutinante de proteína? O BioNemo fornece um plano combinando AlphaFold, RFDiffusion, ProteinMPNN e AlphaFold-multimer para geração e validação iterativas.
Essa modularidade permite que as equipes personalizem os fluxos de trabalho de acordo com seus canais de dados e descoberta. A abordagem de design em primeiro lugar, com contêineres de código aberto e pipelines reproduzíveis, significa que as equipes de biotecnologia podem rapidamente prototipar, testar e escalar aplicativos de biologia generativa.
Casos de uso do mundo real na indústria
O BioNemo evoluiu rapidamente de um kit de ferramentas experimental de IA para um mecanismo robusto para P&D em ciências biológicas de nível empresarial. Em todo o cenário biotecnológico e farmacêutico, ele está sendo usado para acelerar várias fases do pipeline de descoberta, desde a identificação precoce do alvo até a otimização de leads e a validação de candidatos.
As empresas farmacêuticas utilizam o BioNemo para reduza o tempo de descoberta por meio de química generativa e modelagem preditiva. Em vez de confiar apenas na triagem tradicional de alto rendimento ou em experimentos de laboratório úmido, as equipes podem gerar, encaixar e avalie milhares de compostos computacionalmente em questão de horas. Para produtos biológicos, os pesquisadores estão usando o BioNemo para projetar novos ligantes de proteínas, criar enzimas e modelar interações proteína-proteína complexas.
Em organizações de pesquisa contratadas (CROs) e startups de biotecnologia, o BioNemo permite que as equipes escalem com infraestrutura limitada usando microsserviços em contêineres e implantação em nuvem. Sua primeira abordagem de API permite uma integração perfeita em plataformas existentes, como o LIMS.1, ELN ou sistemas de laboratório automatizados.
Instituições acadêmicas e de pesquisa também se beneficiam do BioNemo flexibilidade de código aberto e fluxos de trabalho de alto desempenho. Projetos como dobramento completo do proteoma, triagem de ligantes em grande escala ou anotação de variante com base na estrutura estão se tornando mais acessível graças à eficiência do modelo e à otimização computacional do BioNemo.
Seja apoiando químicos computacionais, biólogos moleculares ou bioinformáticos, o BioNemo está rapidamente se tornando uma camada fundamental na transformação digital da descoberta molecular.
Prático: DiffDock
Nesta demonstração, usaremos a interface web DiffDock da NVIDIA BioNemo para prever como a molécula antiviral Nirmatrelvir (o ingrediente ativo do Paxlovid) se liga à protease principal (Mpro) do SARS-CoV-2, um alvo do mundo real com uma estrutura cristalina conhecida. Isso permitirá que você valide as previsões do modelo com base em dados conhecidos experimentalmente.
%2011.13.24%E2%80%AFa.%C2%A0m..png)
Etapa 1: acessar a interface de usuário da Web do DiffDock
Vá para: https://build.nvidia.com/mit/diffdock. Você verá a interface dividida em dois lados:
- Entrada (à esquerda): para carregar sua molécula e proteína alvo
- Saída (à direita): para ver as poses e pontuações de encaixe previstas.
Etapa 2: Preparar arquivos de entrada
Baixe a molécula: Nirmatrelvir está disponível em formatos 3D no PubChem (formato 3D SDF) e salve como nirmatrelvir.sdf
Depois de baixar o arquivo.pdb da proteína alvo, é importante limpe a estrutura antes de usá-la no DiffDock. A maioria das estruturas cristalinas inclui elementos extras, como moléculas de água, cofatores ou ligantes cristalográficos, que podem interferir nas previsões de encaixe. Para garantir resultados confiáveis, precisamos isolar apenas a cadeia proteica relevante, normalmente a cadeia A, e remova quaisquer resíduos não padronizados.
Esta etapa pode ser feita usando o PyMol, mas se você não o tiver instalado, poderá obter o mesmo resultado usando Baixe a proteína SARS-CoV-2 Main Protease (Mpro) no formato PDB legado e salve como 7vH8.pdb7vh8.pdb diretamente em um caderno jupyter. Ao executar um script curto, você gerará um arquivo mpro_chain_cleaned.pdb limpo que contém somente o backbone proteico necessário para que o DiffDock funcione corretamente. Isso garante que a entrada se concentre exclusivamente na verdadeira bolsa de ligação e evite previsões enganosas causadas por átomos remanescentes na estrutura.
!pip install Bio
from Bio.PDB import PDBParser, PDBIO, Select
class CleanChain(Select):
def accept_residue(self, residue):
return residue.id[0] == ' ' # Keep only standard residues
parser = PDBParser(QUIET=True)
structure = parser.get_structure("Mpro", "7VH8.pdb")
model = structure[0]
chain = model['A'] # Select chain A only
from Bio.PDB.Structure import Structure
from Bio.PDB.Model import Model
from Bio.PDB.Chain import Chain
new_structure = Structure("Cleaned")
new_model = Model(0)
new_chain = Chain("A")
for residue in chain:
if residue.id[0] == ' ': # Exclude HETATM, waters, ligands
new_chain.add(residue)
new_model.add(new_chain)
new_structure.add(new_model)
io = PDBIO()
io.set_structure(new_structure)
io.save("mpro_chain_cleaned.pdb", select=CleanChain())Etapa 3: Carregar arquivos para a interface DiffDock
Antes de executar o DiffDock, é uma boa ideia validar seus arquivos de entrada para garantir que estejam formatados corretamente. Você pode verificar isso rapidamente enviando seu .sdf (ligante) e .pdb (proteína) arquivos para Visualizador Mol*, um visualizador de estruturas moleculares 3D de código aberto. Se os arquivos abrirem e renderizarem sem erros, isso confirma que eles contêm coordenadas atômicas válidas e podem ser usados com segurança como entrada para encaixe. Essa etapa ajuda a detectar problemas como cadeias vazias, tipos de átomos não suportados ou moléculas mal formatadas antes de acionar erros no servidor.
%2011.17.53%E2%80%AFa.%C2%A0m..png)
No painel esquerdo (Entrada):
- Em Molécula, clique em “Carregar novo arquivo” e selecione nirmatrelvir.sdf
- Em Proteína alvo, clique em “Carregar novo arquivo” e selecione mpro_chain_cleaned.pdb
- Em seguida, ajuste os parâmetros:
- Poses geradas → 20 (padrão recomendado)
- Etapas de difusão → 1
- Divisões de tempo de difusão → 20
- Por fim, clique em Executar
%2011.19.52%E2%80%AFa.%C2%A0m..png)
Etapa 4: Revise e interprete os resultados
Quando o modelo terminar de funcionar, o painel de saída exibirá uma visualização 3D das poses de ligação previstas entre o Nirmatrelvir e a proteína Mpro. Você pode explorar cada pose classificada de acordo com a qualidade de encadernação prevista, indicando que o modelo identificou com sucesso uma bolsa de encadernação biologicamente significativa.
%2011.20.57%E2%80%AFa.%C2%A0m..png)
Para interpretar melhor os resultados do encaixe, o DiffDock fornece uma lista classificada das poses de ligação previstas, cada uma pontuada com base em uma estimativa de energia inferida pelo modelo. Pontuações mais altas sugerem configurações de ligação menos estáveis ou menos prováveis, enquanto pontuações mais baixas (valores mais negativos) normalmente correspondem a interações mais favoráveis. Os usuários podem explorar visualmente como as diferentes poses são distribuídas no local de encadernação e se concentrar nas previsões mais bem classificadas. Quando várias poses se agrupam em torno da fenda catalítica conhecida, como é o caso do SARS-CoV-2 Mpro e do Nirmatrelvir, isso sugere fortemente que o modelo identificou corretamente um modo de ligação biologicamente relevante.
%2011.23.07%E2%80%AFa.%C2%A0m..png)
Esse resultado é especialmente poderoso quando comparado à estrutura determinada experimentalmente (PDB: 7VH8), que mostra o Nirmatrelvir ocupando a mesma fenda catalítica. Embora o DiffDock faça suas previsões sem conhecimento prévio do complexo real, geralmente é capaz de reproduzir a pose correta dentro de alguns angstroms de RMSD (Root Mean Square Deviation), comparável à precisão do nível de cristal.
Este exemplo ilustra como o DiffDock pode ser usado para simular interações medicamentosas alvo, abrindo as portas para testes rápidos de hipóteses, triagem virtual e validação em estágio inicial sem exigir software de encaixe tradicional ou intervenção especializada. É um vislumbre de como a IA pode acelerar tarefas que antes exigiam dias ou semanas de química computacional ou modelagem cristalográfica.
Olhando para o futuro
O BioNemo está em constante evolução. Espere mais modelos de base multimodais, maiores LLMs de proteínas e uma integração mais profunda com automação de laboratório e sistemas de descoberta em tempo real. À medida que a biotecnologia corporativa adota pipelines nativos de IA, a BioNemo está posicionada para se tornar a espinha dorsal computacional da P&D moderna, unindo design molecular, visão biológica e inovação escalável.
Se você está construindo o futuro da descoberta molecular, a BioNemo oferece uma plataforma poderosa, flexível e pronta para produção para aplicar a IA generativa em biologia. Agora é a hora de explorar o que é possível e escalar o que funciona.
Na Marvik, trabalhamos com empresas de biotecnologia e organizações de ciências biológicas para operacionalizar a IA, desde os primeiros experimentos até plataformas de descoberta totalmente integradas. Nossa equipe combina profundo conhecimento em engenharia de IA com experiência em biotecnologia do mundo real, ajudando empresas a implantar soluções baseadas em tecnologias como BioNemo, AlphaFold e grandes modelos moleculares.
Referências
1 O LIMS (Sistema de Gerenciamento de Informações Laboratoriais) e o ELN (Caderno Eletrônico de Laboratório) são plataformas amplamente utilizadas em biotecnologia e farmácia. O LIMS está focado no gerenciamento de amostras, fluxos de trabalho e conformidade em todas as operações de laboratório, enquanto o ELN é projetado para documentar procedimentos experimentais, resultados e insights científicos em um formato digital pesquisável. Juntos, eles permitem pesquisas estruturadas, rastreáveis e reproduzíveis, tornando-os ambientes ideais para integrar ferramentas baseadas em IA, como o BioNemo.







.png)